|
Сравнительная характеристика различных методов исследования состояния эндометрия.
Объективная оценка состояния эндометрия является одним из решающих факторов для успешного проведения процедуры ЭКО. До сих пор наши знания относительно многих биологических механизмов, включая факторы маточного кровотока, секреции эндометрием специфичного протеина и другие факторы, которые регулируют и определяют успешную имплантацию, все еще ограничены. Адекватно быстрое увеличение и дифференцирование эндометрия в течение пролиферативной фазы цикла должно сопровождаться своевременными секреторными изменениями в течение лютеиновой фазы менструального цикла. Эти изменения находятся под влиянием гормональных факторов. Существует ряд методов, позволяющих с той или иной степенью объективности оценить изменения, происходящие в репродуктивной системе на протяжении менструального цикла [1]. К ним относятся измерение базальной температуры, определение уровня эстрадиола (Е) и прогестерона в сыворотке крови, гистологическое исследование биоптата эндометрия. Эти методы давно известны и широко используются в практике. Однако первые два недостаточно информативны, а третий инвазивен, что ограничивает его применение, особенно при подготовке пациентки к ЭКО. В последние годы широко применяется метод ультразвукового наблюдения за ростом фолликула и толщиной эндометрия, который в сочетании с гормональным мониторингом используется в стимуляции овуляции суперовуляции. Одним из альтернативных методов исследования состояния эндометрия является допплерометрическое исследование характера кровотока в сосудах эндометрия [24, 34]. Объективная оценка изменений (количественная и качественная) в течение менструального цикла проведена на основании определения физических свойств эндометрия методом ультразвукового сканирования [22, 41]. В медицине эффект Допплера применяется в основном для измерения скорости тока крови, причем отражающей поверхностью в данном случае служат клетки крови и в первую очередь эритроциты. Под кривыми скоростей кровотока подразумевается графическое отражение изменений средней моментальной или максимальной скорости на протяжении сердечного цикла. Систолодиастолическое соотношение, индекс резистентности, пульсационный индекс отражают сосудистое сопротивление периферической части сосудистого русла. Его увеличение отражается главным образом на уменьшении диастолического компонента допплеровского спектра кривой кровотока, что приводит к повышению численных значений вышеперечисленных индексов. Высокочастотные преобразователи (6,5-7,5 MГц), установленные в датчиках для трансвагинального исследования, позволили не только увеличить разрешающую способность и визуализацию структур матки, но и сочетать исследование в В-режиме одновременно с допплерометрией [21, 32, 46, 56, 62]. Цветное отображение кровотока, а также количественный и качественный анализ дали возможность оценить импеданс кровотока в маточных артериях, что позволило охарактеризовать маточную перфузию [34, 35, 53, 56]. В последнее время появился ряд работ, в которых не только даны допплерометрические характеристики кровотока, происходящие в течение менструального цикла [15, 34], но и предпринята попытка связать их с эффективностью ЭКО [26, 27, 61]. Структура и функция кровеносных сосудов эндометрия Кровеносные сосуды эндометрия формируют сосудистую сеть, имеющую ряд специфических особенностей. В отличие от сосудистой системы других органов и тканей, поддерживающих постоянную функцию и структуру на протяжении всей жизни, васкуляризация эндометрия динамически изменяется в течение относительно короткого времени — менструального цикла [43]. Спиральная артериола имеет пружинообразный вид, что становится более явным в течение секреторной фазы менструального цикла. По своему строению спиральные артериолы отличаются от других артериол относительно меньшим количеством эластина в составе внутренней стенки артериолы [18]. Каждая спиральная артериола обеспечивает кровью участок в 4-9 мм[7], с небольшими перекрытиями между областями или без них. Непосредственно под поверхностью эндометрия спиральные артериолы разветвляются и образуют подэпителиальное капиллярное сплетение. Анатомия кровоснабжения базальной части эндометрия остается относительно неизменной в течение всего менструального цикла. Функциональный слой эндометрия и архитектура его кровоснабжения постоянно изменяются в ответ на воздействие половых стероидов в зависимости от фазы менструального цикла. Рассматривая отдельные этапы ангиогенеза функционального слоя эндометрия, ряд авторов [31] выделяют четыре основных стадии в процессе роста сосудов: В промежутке между окончанием менструации и овуляцией в процессе васкуляризации эндометрия отчетливо прослеживаются две различные фазы роста сосудов: В то время как морфологические изменения, происходящие в эндометрии и его васкуляризации, не вызывают сомнений, вопрос о факторах, оказывающих влияние на процесс ангиогенеза сосудов эндометрия, остается поводом для дискуссий. Преобладающее значение в ангиогенезе сосудов эндометрия принадлежит эстрогенам [17, 51], однако прямое или косвенное влияние на ангиогенез имеют сосудистый эндотелиальный фактор роста [12, 51], фактор роста фибробластов [19, 25], TGF-a [29], интерлейкин (IL) -1 [52] и IL-6 [58, 59], эпидермальный фактор роста и IL-8 [14], ангиотензин-II [6] и др. У большинства плацентарных млекопитающих ограниченное увеличение микрососудистой проницаемости эндометрия является одним из первых признаков наступления имплантации. Так, в эксперименте в период имплантации увеличение проницаемости сосудов эндометрия выявлено у крыс [46], морских свинок [16], овец [10] и свиней [30]. Несмотря на идентичность реакции сосудов эндометрия на внедрение эмбриона у млекопитающих, остается немало неизученных физиологических механизмов и причин этого явления. У женщин в месте имплантации эмбриона на 9-й день после овуляции Hertig и соавт. (1956) выявили отек эндометрия. При использовании электронной микроскопии показано, что основные изменения в микрососудистой архитектуре эндометрия крыс во время увеличения проницаемости сосудов, индуцируемого внедрением бластоцисты, [44] начинаются к концу 5-х суток беременности. На 6-е сутки беременности выявлено отсутствие капилляров, окружающих бластоцисту, и возникает в результате имплантации аваскулярная зона ~ 420-210 мм в диаметре [45]. Как ни странно, но именно в момент высокой метаболической активности эмбрион оказывается изолированным от материнских энергетических источников обеспечения его жизнедеятельности. Существует ряд гипотез, объясняющих это парадоксальное, на первый взгляд, явление. По одной из них [17,51], наличие аваскулярной зоны в месте имплантации эмбриона позволяет иммунологически ослабить материнские ткани и тем самым расширить возможности вторжения трофобласта в ткань эндометрия. Подобная реакция может быть частью механизма, позволяющего избежать иммунологического отторжения бластоцисты матерью. Аваскулярная зона места имплантации окружена сосудами сравнительно большего диаметра (капилляры, наиболее близко расположенные к месту имплантации эмбриона, имеют средний диаметр 18,5±2,5 мкм по сравнению с капиллярами, расположенными несколько дальше от места имплантации, — 7,5±0,4 мкм). Кроме того, скорость кровотока через эти расширенные или относительно крупные капилляры в зоне имплантации эмбриона значительно снижена. Отмечается периодическое снижение скорости кровотока до нулевых значений. При помощи электронной микроскопии выявлены агрегация и адгезия форменных элементов крови (чаще лейкоцитов) и/или их вращение у стенок расширенного сосуда в зоне места имплантации эмбриона, что достаточно редко происходит в капиллярах аналогичного диаметра, отдаленных от места имплантации. Допплерометрия кровотока в сосудах матки в программах вспомогательной репродукцмии. Допплерометрия кровотока маточных артерий, проводимая при помощи цветного допплеровского картирования, предложена как один из физиологических параметров для косвенной оценки способности эндометрия к имплантации эмбриона. Предложено проводить оценку допплерометрических характеристик кровотока в маточных артериях и их ветвях, размещенных во внешней трети миометрия [20]. R. Goswamy и P. Steptoe [27] показали, что характеристика маточного кровотока в значительной степени определяется содержанием эстрогенов в сыворотке крови и продолжительностью их влияния. Так, при увеличении концентрации эстрогенов в крови увеличивалась и маточная перфузия, а при снижении их концентрации она снижалась. Кроме того, интенсивность кровотока в маточных артериях вновь увеличивалась параллельно увеличению концентрации прогестерона и эстрогенов в лютеиновой фазе цикла. Последние исследования выявили достоверные различия сосудистого сопротивления маточных артерий при недостаточности лютеиновой фазы по сравнению с таковым у женщин при нормальном соотношении гормонов в лютеиновую фазу цикла. При этом исследования маточного кровотока проводили параллельно с анализом концентрации прогестерона в сыворотке крови и биопсией эндометрия во вторую фазу цикла [34, 60], что позволяло соотнести уровень гормонов сыворотки крови, исследуемые характеристики кровотока и изменения, происходящие в эндометрии. Подтверждением этих данных может служить исследование, проведенное R. Achiron и соавт. [5] у женщин с преждевременным истощением функции яичников: при применении заместительной гормональной терапии значительно улучшаются допплерометрические характеристики маточного кровотока. Однако говорить о достоверной корреляции между уровнем эстрогенов в сыворотке крови, взятой из локтевой вены, и характером кровотока в сосудах матки представляется спорным [2, 3]. Так, S. Kupesic и соавт. [35] показали, что при СПКЯ (синдром поликистозных яичников), несмотря на нормальные показатели Е в сыворотке крови, увеличивается сопротивление кровотоку в маточной артерии, что отрицательно сказывается на имплантации эмбриона. Исследования, проведенные P. Serafini и соавт. [47] также не подтвердили предположение о связи между концентрацией Еи прогестерона с интенсивностью кровотока в сосудах матки. всех женщин, обследованных при сравнимых концентрациях стероидных гормонов в крови и сравнимой дозировке гонадотропинов, при достижении подобных концентраций Ев сыворотке крови были выявлены различные характеристики маточного кровотока. S. Bassil и соавт. [8] при исследовании содержания Ев сыворотке крови выявили достоверную связь между его концентрацией и интенсивностью маточной перфузии в циклах ЭКО с применением а-ГнРГ и гонадотропинов. Аналогичные данные получены другими авторами [11]. Назначение ХГ вызывало снижение маточного кровотока и соответственно увеличение индекса сопротивления (RI) на 48 ч, затем с увеличением секреции прогестерона и Еотмечены значительные улучшения в характеристиках маточного кровотока. Индекс резистентности, определяемый за 2 дня перед введением человеческого менопаузального гонадотропина (чМГ; в циклах с применением а-ГнРГ, “длинный протокол”), оказался выше у тех пациенток, у которых беременность не наступила. Изучая действие а-ГнРГ, C. Battaglia и соавт. [9] показали, что изменение кровотока матки (супрессивный эффект проявлялся на 25-й день введения) связано исключительно с гипоэстрогенемией. Эти данные подтверждены другими исследователями [5]. При измерении скорости кровотока в маточных, радиальных, спиральных и яичниковых артериях в течение периовуляторного периода в спонтанном и индуцируемом антиэстрогенами циклах с подтвержденной овуляцией выявлены лучшие допплерометрические характеристики кровотока в естественных циклах [33]. Отмечено, что увеличение сосудистого сопротивления кровотока, как правило, выражается в увеличении индекса пульсации (PI), что достоверно снижает вероятность наступления беременности в течение циклов ЭКО [36, 54, 57, 62, 63]. Данные, полученные при измерении PI спиральных артерий, подтверждают эти результаты [33]. Показано наличие положительной корреляции между концентрацией Есыворотки крови и величиной кровотока в эндометрии [34], однако при увеличении концентрации прогестерона корреляция между концентрацией Еи уровнем кровотока исчезает [23]. Аналогичные данные получены А.Н. Стрижаковым и А.И. Давыдовым [4] при допплерометрии сосудов малого таза у больных с внутренним эндометриозом. Эти данные можно интерпретировать как результат недостаточного локального эстрогенного влияния на миометрий и эндометрий. При исследовании уровня Ев сыворотке крови, полученной из локтевой, трубной и маточной вен, выявлены существенные различия этих значений [2, 3]. J. Zaidi и соавт. [63] отметили достоверные различия в допплерометрических характеристиках кровотока в маточных сосудах при различной ультразвуковой структуре эндометрия (более частое отсутствие кровотока в базальных артериях эндометрия при гипер-эхогенной ультразвуковой структуре), причем когда субэндометриальный кровоток не был обнаружен, имплантации не наступало. При проспективном изучении допплерометрических характеристик кровотока, измеряемых на участке первого деления на ветви маточной артерии, P. Serafini и соавт. [47] сделали вывод, что диастолический кровоток и многослойная структура эндометрия являются наиболее ценными прогностическими критериями для оценки вероятности наступления беременности при проведении циклов с использованием вспомогательных репродуктивных технологий. На основании этих данных с применением регрессивного анализа получено уравнение для вычисления ультразвукового имплантационного индекса матки [48]. Индекс резистенции (RI) имеет меньшую значимость для прогноза наступления и развития беременности по сравнению с характеристиками диастолического маточного кровотока [47]. Выявлено, что пороговые значения диастолического кровотока оказались статистически недостоверными для прогнозирования беременности по сравнению со средними значениями PI, определенными в обеих маточных артериях [47]. P. Levi-Setti и соавт. [37] утверждают, что наиболее ценным прогностическим критерием для оценки вероятности наступления беременности в циклах ЭКО является измерение величины PI перед введением разрешающей дозы чМГ. Значения PI, меньшие или равные 3,0, могут рассматриваться благоприятным прогностическим фактором в циклах ЭКО. Другие авторы [63] не только подтверждают эти результаты, но и дополняют их: PI от 2,0 до 3,0, измеряемый перед введением разрешающей дозы чМГ, рассматривается как показатель, не только влияющий на частоту наступления беременности, но и существенно повышающий частоту имплантации. При измерении PI перед введением разрешающей дозы ХГ (или в день пика ЛГ в естественных циклах) прогностически благоприятными считаются значения PI, не превышающие 3,3 [11, 13]. Как показывают C. Steer и соавт. [55], PI имеет высокую корреляцию с биохимическими маркерами имплантации, включая 24 кД протеин, рецепторами Еи гистологическими данными состояния эндометрия. Кроме того, неудовлетворительные допплерометрические характеристики маточного кровотока выявлены не только у пациенток с неудачной попыткой ЭКО, но и у больных с ранним невынашиванием беременности после проведения ЭКО [53]. Таким образом, измерение таких допплерометрических показателей кровотока, как PI и RI маточных сосудов, может быть использовано для прогноза возможности наступления беременности в циклах ЭКО. С другой стороны, M. Locci и соавт. [38] при допплерометрии кровотока в маточных артериях не нашли каких-либо различий в его показателях, полученных у фертильных женщин и у больных, у которых беременность наступила в результате вспомогательных репродуктивных технологий. Применение современных ультразвуковых аппаратов с высокой разрешающей способностью позволяет оценить кровоток не только в маточных артериях, но также в более мелких маточных сосудах, что существенно повышает объективность полученных данных [34]. Допплерометрия кровотока сосудов матки не только позволяет получить характеристику кровотока, но и в 96% случаев дает возможность получить критерии готовности эндометрия к имплантации эмбриона. Кроме того, при недостаточности кровоснабжения эндометрия возможно провести своевременную его коррекцию для успешного завершения циклов вспомогательных репродуктивных технологий [49, 50]. Анализ приведенных данных позволяет заключить, что допплерометрия сосудов матки дает дополнительную информацию о состоянии репродуктивной системы женщины, и можно полагать, что она является достаточно объективным методом для прогнозирования возможности наступления беременности у женщин при проведении ЭКО. Таким образом, допплерометрическая оценка кровотока сосудов позволяет судить о функциональных особенностях эндометрия, что существенным образом дополняет широко используемые его анатомические характеристики. Б. Каменецкий Международный центр репродуктивной медицины, Санкт-Петербург Литература 1. Айламазян Э.К., Потин В.В., Рулев В.В. Диагностика гормональной недостаточности яичников. Актуальные вопросы физиологии и патологии репродуктивной системы женщины. Ст-Петербург 1995; 16-19. 2. Савицкий Г.А. Миома матки. Ст-Петербург: Путь 1994; 214. 3. Савицкий Г.А. Регуляция уровня эстрадиола и прогестерона в локальном кровотоке матки и маточной трубы. Вестник АМН СССР 1990; 5: 43-46. 4. Стрижаков А.Н., Давыдов А.И. Клиническая трансвагинальная эхография. М 1994; 174. 5. Achiron R., Levran D., Sivan E. et al. Endometrial blood flow response to hormone replacement therapy in women with premature ovarian failure: a transvaginal Doppler study. Fertil Steril 1995; 63: 3: 550-554. 6. Ahmady O., Gad M., Sheimy R. et al. Comparative study between sonography, pathology and UGP in women with perimenopausal bleeding. Anticancer Res 1996; 16: 4B: 2309-2313. 7. Balash J.S., Vanrell J.A. Corpus luteum insufficiency and fertility: a matter of controversy. Human Reprod 1987; 2: 557-567. 8. Bassil S., Magritte J.P., Roth J. et al. Uterine vascularity during stimulation and its correlation with implantation in in-vitro fertilization. Human Reprod 1995; 10: 6: 1497-1501. 9. Battaglia C., Artini P.G., Bencini S. et al. Doppler analysis of uterine blood flow changes in spontaneous and medically induced menopause. Gynecol Endocrinol 1995; 9: 2: 143-148. 10. Birnholz J., Hrozencik D. Technical improvement for ultrasonic study of the endometrium. Int J Fertil 1988; 33: 3: 194-200. 11. Bustillo M., Krysa L.W., Coulam C.B. Uterine receptivity in an oocyte donation programme. Hum Reprod 10: 442-445. 12. Chan F.Y., Chau M.T., Pun T.C. et al. Limitations of transvaginal sonography and color Doppler imaging in the differentiation of endometrial carcinoma from benign lesions. J Ultrasound Med 1994; 13: 8: 623-628. 13. Cohen J.J., Debache C., Pigeau F. et al. Sequential use of clomiphene citrate, human menopausal gonadotropin and human chorionic gonadotropin in human in vitro fertilization. II. Study of luteal adequacy following aspiration of the preovulatory follicles. Fertil Steril 1984; 42: 360. 14. Coulam C.B., Stern J.J., Soenksen D.M. et al. Comparison of pulsatility indices on the day of oocyte retrieval and embryo transfer. Hum Reprod 1995; 10: 82-84. 15. Davies D.W., Jenkins J.M., Anthony F.W. et al. Biochemical monitoring during hormone replacement therapy cycles for transfer of cryopreserved embryos in patients with functional ovaries. Hum Reprod 1991; 6: 934-938. 16. de-Ziegler D., Bouchard P. Understanding endometrial physiology and menstrual disorders in the 1990. Curr Opin Obstet Gynecol 1993; 5: 3: 378-388. 17. Eyster K.M., Stouffer R.L. Adenylate cyclase in the corpus luteum of the rhesus monkey. II. Sensitivity to nucleotides, gonadotropins, catecholamines and non-hormonal activators. Endocrinology 1985; 116: 1552-1558. 18. Ferenczy A., Gelfand M.M. Proliferation kinetics of human endometrium during the normal menstrual cycle. Am J Obstet Gynecol 1979; 133: 859-867. 19. Ferenczy A. Anatomy and histology of the uterine corpus. Blaustein’s Pathology of the Genital Tract. Ed. T.G. Kurman. 3 ed. Springer-Verlag 1987; 6: 257-291. 20. Fleischer A.C., Cullinan J.A., Jones H.W. et al. Serial assessment of adnexal masses with transvaginal color Doppler sonography. Ultrasound Med Biol 1995; 21: 4: 435-441. 21. Fleischer A.C., Herbert C.M., Hill G.A. et al. Transvaginal sonography of the endometrium during induced cycles. J Ultrasound Med 1991; 10: 93-95. 22. Fleischer A.C., Pittaway D.E., Beard L.A. et al. Sonographic depiction of endometrial changes occurring with ovulation induction. J Ultrasound Med 1984; 3: 341-346. 23. Forrest T.S., Elyaderani M.K., Kuilenburg M.I. et al. Cyclic endometrial changes: US assessment with histologic correlation. Radiology 1988; 167: 233-237. 24. Fraser I.S., Peek M.J. Effects of exogenous hormones on endometrial capillaries. Steroid Hormones and Uterine Bleeding. Ed. N.J. Alexander, C. d’Arcangues. Washington: AAAS Press 1992; 131-134. 25. Frydman R., Testart J., Giacomini P. et al. Hormonal and histological study of the luteal phase in women following aspiration of the preovulatory follicle. Fertil Steril 1992; 38: 312-313. 26. Gonen Y., Casper R.F. Prediction of implantation by the sonographic appearance of the endometrium during controlled ovarian stimulation for in vitro fertilization (IVF). J In Vitro Fertil Embryo Transf 1990; 7: 146-152. 27. Goswamy R.K., Steptoe P.C. Doppler ultrasound studies of the uterine artery in spontaneous ovarian cycles. Hum Reprod 1988; 3: 721-726. 28. Goswamy R.K., Williams G., Steptoe P.C. Decreased uterine perfusion — a cause of infertility. Hum Reprod 1988; 3: 955-959. 29. Hitschmann F., Adler L. Der Bau der Uterus-schleimhaut des geschlestsreifen Weibes mit besonderer Berrucksichtigung der Menstruation. Monatschr Geburtsch Gynakl 1908; 27: 1. 30. Kemmann E., Gemzell G., Beinert B. Treatment of patient with hyperprolactinemia. Am J Obstet Gynecol 1977; 129: 4: 145-149. 31. Kiesel I., Rabe T., Schleef J. Pulsatil secretory pattern of gonadotropins and steroid during the follicular and luteal phase of the menstrual cycle in women. Pulsatile GnRH 1925. Procced. 3rd Ferring Symp. Haarlem 1986; 43-50. 32. Kupesic S. The first three weeks assessed by transvaginal color Doppler. J Perinat Med 1996; 24: 4: 301-317. 33. Kupesic S., Kurjak A. The assessment of uterine and ovarian perfusion in infertile patients. Eur J Obstet Gynecol Reprod Biol 1997; 71: 2: 151-154. 34. Kupesic S., Kurjak A. Uterine and ovarian perfusion during the periovulatory period assessed by transvaginal color Doppler. Fertil Steril 1993; 60: 3: 439-443. 35. Kupesic S., Kurjak A., Vujisic S. et al. Luteal phase defect: comparison between Doppler velocimetry, histological and hormonal markers. Ultrasound Obstet Gynecol 1997; 9: 2: 105-112. 36. Lessey B.A., Yeh I., Castelbaum A.J. et al. Endometrial progesterone receptors and markers of uterine receptivity in the window of implantation. Fertil Steril 1996; 65: 3: 477-483. 37. Levi-Setti P.E., Rognoni G., Bozzo M. et al. Color-Doppler velocimetry of uterine arteries in pregnant and nonpregnant patients during multiovulation induction for IVF. J Ass Reprod Genet 1995; 12: 7: 413-417. 38. Locci M., Nazzaro G., De-Placido G. et al. Angiogenesis: a new diagnostic aspect of obstetric and gynecologic echography. J Perinat Med 1993; 21: 6: 453-473. 39. Rajaniemi H.J., Ronnberg L., Kauppila A., Ylostalo P., Jalkanen M., Saastameinen J., Selander J. Luteinizing hormone receptors in human ovarian follicles and corpora lutea during the menstrual cycle and pregnancy. J Clin Endocrinol Metab 1981; 54: 307-313. 40. Rabinowitz R., Laufer N., Lewin A. et al. The value of ultrasonographic endometrial measurement in the prediction of pregnancy following in-vitro fertilization. Fertil Steril 1986; 45: 824-828. 41. Ramsey E.M. Vascular anatomy. Biology of the Uterus. Ed. R.M. Wynn. 2nd ed. New York — London: Plenum Press 1982; 59-76. 42. Ritchie W.G. Sonographic evaluation of normal and induced ovulation. Radiology 1986; 161: 1: 1-10. 43. Rogers P., Milne B., Trounson A. A model to show uterine receptivity and embryo viability following ovarian stimulation for in vitro fertilization. J In Vitro Fertil Embryo Transf 1986; 3: 93-98. 44. Rogers P.A.W. Structure and function of endometrial blood vessels. Hum Reprod Update 1996; 2: 1: 57-62. 45. Rogers P.A.W., Murphy C.R., Gannon B.J. Changes in the spatial organization of the uterine vasculature during implantation in the rat. J Reprod Fertil 1982; 65: 211-214. 46. Savard K., Marsh J.M., Rice B.F. Gonadotrophins and ovarian steroidogenesis. Res Prog Horm Res 1965; 21: 285-356. 47. Serafini P., Batzofin J., Nelson J. et al. Sonographic uterine predictors of pregnancy in women undergoing ovulation induction for assisted reproductive treatments. Fertil Steril 1994; 62: 815-822. 48. Serafini P., Nelson J., Batzofin J. et al. Preovulatory sonographic uterine receptivity index (SURI): usefulness as an indicator of pregnancy in women undergoing assisted reproductive treatments. J Ultrasound Med 1995; 14: 10: 751-755. 49. Sharma V., Riddle A. et al. An analysis of factors influencing the establishment of a clinical pregnancy in an ultrasound-based ambulatory IVF program. Fertil Steril 1988; 49: 3: 468-478. 50. Sher G., Dodge S., Maassarani G. et al. Management of suboptimal sonographic endometrial patterns in patients undergoing in-vitro fertilization and embryo transfer. Hum Reprod 1993; 8: 347-349. 51. Sheth S., Hamper U.M., McCollum M.E. et al. Endometrial blood flow analysis in postmenopausal women: can it help differentiate benign from malignant causes of endometrial thickening? Radiology 1995; 195: 3: 661-665. 52. Shuiling G.A. Secretion of LH and FSH: modulation by GNRH and estrogens basis and clinical aspect. Pulsatil GNRH. 3rd Ferring Symp. 1986; 29-42. 53. Soules M.R., Steiner R.A., Clifton D.K. et al. Abnormal patterns of pulsatile luteinizing hormone in women with luteal phase deficiency. Obstet Gynecol 1984; 63: 626-629. 54. Spernol R., Hecher K., Schwarzgruber J. et al. Doppler flow measurements of the uterine artery. A prognostic factor for success in treatment by IVF? J Ultrasound Med 1993; 14: 4: 175-177. 55. Steer C.V., Campbell S., Tan S.L. et al. The use of transvaginal colour flow imaging after in vitro fertilization to identify optimum conditions before embryo transfer. Fertil Steril 1992; 57: 372-376. 56. Steer C.V., Tan S.L., Dillon D. et al. Vaginal colour Doppler assessment of uterine artery impedance correlates with immunohistochemical markers of endometrial receptivity required for the implantation of an embryo. Fertil Steril 1995; 63: 101-108. 57. Steer C.V., Campbell S., Pampiglione J.S. et al. Transvaginal colour flow imaging of the uterine arteries during the ovarian and menstrual cycles. Hum Reprod 1990; 5: 391-395. 58. Stuart B., Drumm J., FitzGerald D.E. et al. Fetal blood flow velosity waveforms in normal pregnancy. Br J Obstet Gynec 1980; 87: 9: 780-785. 59. Tabibzadeh S. Human endometrium: an active site of cytokine production and action. Endocr Rev 1991; 12: 272-290. 60. Tabibzadeh S., Kong Q.F., Babaknia A. et al. Progressive rise in the expression of interleukin-6 in human endometrium during menstrual cycle is initiated during the implantation window. Hum Reprod 1995; 10: 10: 2793-2799. 61. Tan S.L., Zaidi J., Campbell S. et al. Blood flow changes in the ovarian and uterine arteries during the normal menstrual cycle. Am J Obstet Gynecol 1996; 175: 3: 1: 625-631. 62. Tekay A., Jouppila P. Intraobserver variation in transvaginal Doppler blood flow measurements in benign ovarian tumors. Ultrasound Obstet Gynecol 1997; 9: 2: 120-124. 63. Zaidi J., Campbell S., Pittrof R. et al. Endometrial thickness, morphology, vascular penetration and velocimetry in predicting implantation in an in vitro fertilization program. Ultrasound Obstet Gynecol 1995; 6: 3: 191-198. Конгрессы, симпозиумы, семинары. 10-й конгресс Европейского общества по гинекологической эндоскопии Лисабон, Португалия, 21-24 ноября, 2001 Международный симпозиум «Поликистозные яичники» Мельбурн, Австралия, 24 ноября 2001 17-й Всемирный конгресс по фертильности и стерильности Мельбурн, Австралия, 24 ноября-1 декабря, 2001 VIII Конгресс по эндометриозу Сан-Диего, США, 24-27 февраля, 2002 12-й Всемирный конгресс по IVF и молекулярной репродукции Буэнос-Айрес, Аргентина, 16-19 марта, 2002 Встреча Британского общества фертильности Оксфорд, Англия, 10-2 апреля, 2002 7-й конгресс Европейского общества по контрацепции Генуя, Италия, 10-13 апреля, 2002 IV Международный симпозиум по преимплантационной генетике Кипр, Лимасол, 11-13 апреля, 2002 34-й Международный конгресс по патофизиологии беременности Балатон, Венгрия, 27-30 июня, 2002 II Всеобщая конференция «Бесплодие в III тысячелетии» Прага, Чехия, 16-17 ноября, 2002 18-й Европейский конгресс по акушерству и гинекологии Любек, Германия, 11-14 июня, 2003 18-й Всемирный конгресс по фертильности и стерильности Монреаль, Канада, 23-28 мая, 2004 |
Источник: www.rusmedserv.com
Что такое гипоплазия правой или левой позвоночных артерий, как лечить это заболевание?
Общая информация
Гипоплазия позвоночных артерий представляет собой врожденное заболевание, характеризующееся их недостаточным развитием. Просвет сосуда в месте его внедрения в костный канал значительно сужается, из-за чего происходит нарушение кровоснабжения тканей головного мозга.
Патология может быть левосторонней, правосторонней или двухсторонней, причем чаще всего нарушение касается правой артерии – по статистике, это явление отмечается у каждого десятого человека в мире.
Причины и факторы риска
К наиболее распространенным факторам риска развития заболевания относятся внутриутробные аномалии развития плода, которые могут возникнуть в результате:
- травм матки во время беременности;
- интоксикации организма матери и ребенка вследствие употребления алкоголя, наркотиков, лекарственных препаратов, курения, воздействия химических или токсических веществ, а также ионизирующей радиации;
- инфекционных заболеваний, перенесенных женщиной в период вынашивания ребенка;
- наследственной предрасположенности.
Полное отсутствие этих факторов не гарантирует отсутствие патологии, так как точные причины ее развития до сих пор не установлены. С течением времени гипоплазия усугубляется из-за снижения эластичности сосудов и отложения в них холестерина, что при недостаточном развитии артерий значительно ускоряет течение заболевания.
Чем отличается правосторонняя гипоплазия от левосторонней?
У правосторонней гипоплазии, которая встречается у пациентов значительно чаще, нет каких-либо специфических симптомов или серьезных отличий.
Разница между этими типами патологии заключается лишь в том, что обе артерии обеспечивают кровоснабжение разных отделов мозга – соответственно, гипоплазия позвоночных артерий справа и слева может привести к разным последствиям и осложнениям.
Опасность и последствия
Нарушения, связанные с гипоплазией, часто списывают на другие заболевания сосудов, из-за чего диагностика патологии значительно осложняется. При несвоевременном лечении ее последствиями могут стать ухудшения зрения, слуха и работы вестибулярного аппарата, изменения состава крови и других биологических жидкостей, а также атеросклероз и тромбоз.
Симптомы и признаки
Дефект может не давать симптомов в течение долгого времени и проявиться только в зрелом возрасте или старости.
В молодом возрасте функции позвоночных артерий берут на себя более тонкие их ответвления, что обеспечивает компенсаторный эффект. Но с годами ресурсы организма начинают исчерпываться, и он больше не может компенсировать нарушения кровотока самостоятельно – в этот период у человека появляются первые неприятные проявления гипоплазии.

- частые и беспричинные головокружения;
- нарушения функций вестибулярного аппарата;
- слабость и снижение работоспособности;
- вялость и сонливость;
- онемение и потеря чувствительности в конечностях (особенно в пальцах);
- искаженное восприятие пространства.
Со временем симптомы нарастают и на первый план выходят те, которые связаны с дефектом правой или левой артерии.
Так, правосторонняя гипоплазия проявляется нарушением эмоционального фона: раздражительностью, частыми перепадами настроения, вялостью, утомляемостью и сонливостью, которая может смениться бессонницей. Человек становится метеозависимым, может чувствовать себя так, как будто в течение долгого времени катался на карусели, спотыкаться при ходьбе и постоянно натыкаться на предметы.
Основная особенность левосторонней гипоплазии – застой крови в сосудах, из-за чего к общим симптомам патологии присоединяются сильные боли в шейном отделе позвоночника, а также повышение артериального давления.
Когда следует обратиться к врачу?
Лечением гипоплазии позвоночных артерий занимается врач-невропатолог, к которому нужно незамедлительно обратиться после появления первых симптомов. Промедление в этом случае может быть чрезвычайно опасным, так как признаки нарушения гемодинамики говорят о том, что организм больше не может компенсировать нарушения кровотока самостоятельно. После выслушивания жалоб пациента и сбора анамнеза в целях уточнения диагноза врач должен назначить дополнительные анализы и исследования.
Диагностика
Выявить гипоплазию на ранних стадиях ее развития чрезвычайно сложно из-за отсутствия характерных симптомов и проявлений. Существует три основных метода диагностики сужения просвета позвоночных артерий, которые включают:
- Ультразвуковое исследование сосудов головы и шеи. В ходе проведения процедуры изображение артерии фиксируется с помощью аппарата УЗИ, после чего проводится анализ типа, интенсивности и диаметра кровотока (серьезным дефектом считается сужение диаметра сосудов до 2-х мм и меньше).
- Томография головы и шеи. Посредством компьютерных и магнитно-резонансных томографов оценивается состояние сосудов, заполненных специальным контрастным веществом.
- Ангиография. Рентгенографическое исследование, которое выявляет аномалии в строении сосудов и позвоночных артерий.
Лечение
Методов специфического лечения гипоплазии позвоночных артерий сегодня не существует. Если заболевание не дает клинических симптомов и выявляется случайно во время профилактического осмотра, специалисты обычно выбирают тактику наблюдения.
Больному рекомендуют отказаться от вредных привычек, нормализовать режим дня и ограничить время работы за компьютером. Также пациентам показана лечебная физкультура, умеренные физические нагрузки и полноценный сон на анатомически правильных подушках.
Гипоплазия имеет особенность обостряться весной и осенью, поэтому в это время следует особенно внимательно относиться к своему здоровью.
На стадии ярко выраженных клинических симптомов гипоплазии правой или левой позвоночной артерии назначается консервативное лечение сосудорасширяющими препаратами – они устраняют неприятные явления и улучшают качество жизни пациента. В случаях, когда имеется риск образования тромбов, показан прием антикоагулянтов (медикаментов, разжижающих кровь).
Кроме того, нужно вылечить сопутствующие заболевания шейного отдела позвоночника (самым распространенным из них является остеохондроз), так как они способны значительно ухудшить состояние пациента.
Если фармакологическая терапия не дает ожидаемого эффекта, врачи прибегают к хирургическому лечению гипоплазии позвоночных артерий. При значительном сужении артерии и остром нарушении кровотока проводится операция, направленная на расширение просвета сосудов и установку специальных имплантатов (стенирование сосудов, ангиопластика).
Профилактика
Так как точные причины заболевания пока что не выяснены, предупредить его практически невозможно. Чтобы снизить риск развития гипоплазии позвоночных артерий у плода, женщинам рекомендуется еще на стадии планирования беременности пройти все исследования (в частности, анализ на TORCH-инфекции) и при необходимости получить адекватное лечение.
В период вынашивания ребенка будущей матери следует отказаться от вредных привычек, вести здоровый образ жизни и по возможности устранить из своей жизни негативные факторы, которые могут оказать влияние на развитие эмбриона.
Риск развития осложнений увеличивается только к старости, но при своевременном лечении, профилактике и соответствующем отношении к своему здоровью их вполне можно избежать.
Признаки беременности по пульсу
- 1 Первые проявления
- 1.1 Предположительные
- 1.2 Вероятные
- 1.3 Достоверные
- 2 Пульс в животе как один из признаков беременности
- 3 Как определить наличие беременности?
Есть много косвенных симптомов, указывающих на зачатие ребенка, хотя ни один из них не гарантирует 100% результата. Определить беременность по пульсу достоверно невозможно. Хотя умеренная тахикардия или гипотония, пульсация в области живота являются предположительными признаками из-за изменений, связанных с дополнительной нагрузкой на сердечно-сосудистую систему женщины.
Первые проявления
Беременность у женщин протекает по-разному: у одних организм сигнализирует об изменении состояния практически сразу, а у других — значительно позже, а некоторые во время беременности не испытывают никаких вторичных признаков ее начала и течения.
Различные похожие симптомы испытывают женщины при явном отсутствии беременности. Симптомы, которые чаще сопровождают наступление зачатия делится на 3 категории:
на
- предположительные;
- вероятные;
- достоверные.
Вернуться к оглавлению
Предположительные
Предположительные проявления наступившего зачатия женщина может узнать самостоятельно. Они появляются на разных сроках и с разной степенью интенсивности. Основные из них указаны в таблице. Далеко не всегда эти симптомы указывают на оплодотворение, иногда они свидетельствуют о наличии аномальных процессов в организме или являются реакцией на воздействие внешних факторов.
| Период после зачатия | Признак беременности |
| Вскоре |
|
| 1—5 неделя |
|
| 2—3 недели |
|
| 2—8 недель |
|
| 3-й месяц |
|
Вернуться к оглавлению
Вероятные
Есть косвенные признаки беременности, которые женщина не может узнать самостоятельно, но они четко видны во время медицинского осмотра. Основные из них указаны в таблице. Как и в случае с предположительными симптомами, они не всегда указывают на оплодотворение, а иногда свидетельствуют о серьезных проблемах со здоровьем или временных физиологических изменениях в организме.
| Период после зачатия, недели | Проявления |
| 1—4 | Усиленная пульсация маточной артерии. |
| 4—12 | Приобретение шейкой матки и влагалищем голубовато-фиолетового оттенка. |
| 8—12 | Увеличение живота и матки. |
| 16—22 | Ощущение движения плода внизу живота. |
Вероятны и другие причины:
- газоотделение;
- миома;
- предменструальный синдром;
- различные опухоли.
Вернуться к оглавлению
Достоверные
Если женщина очень хочет забеременеть, то сразу после возможного зачатия она начнет искать первые симптомы беременности.
Достоверным признаком беременности на ранних сроках является повышение в организме женщины специфического гормона — хорионического гонадотропина, который начинает усиленно вырабатываться фактически с первых дней после зачатия. Его наличие можно проверить в домашних условиях тест-полосками. Второе бесспорное подтверждение беременности — визуализация плодного пузыря или эмбриона во время ультразвуковой диагностики, но не ранее 5-й недели предполагаемого зачатия.
Вернуться к оглавлению
Пульс в животе как один из признаков беременности
Ощущение пульсации в животе является одним из предположительных признаков беременности, который возникает у некоторых женщин вскоре после оплодотворения. Это связано в первую очередь с имплантацией эмбриона и, как следствие, усиленным кровообращением в области матки, началом ее интенсивного роста, незначительными сокращениями, изменениями слизистой, давлением на нижнюю полую вену.
Вернуться к оглавлению
Как определить наличие беременности?
При обнаружении изменения частоты пульса, его увеличения или замедления, а также появления пульсации в области живота, следует незамедлительно обратиться за медицинской консультацией.
Подобные признаки могут указывать на зарождение новой жизни, а иногда свидетельствуют о патологических процессах, протекающих в организме. Определение беременности возможно при помощи домашнего теста или анализа крови, по которому измеряются изменения уровня гормона ХГЧ, а также при помощи УЗИ.
на
Комментарий
Псевдоним
Источник: gipertenziya.lechenie-gipertoniya.ru
Обследование
Важность такого метода исследования невозможно переоценить. Это уникальная возможность определить патологические изменения, вызывающие нарушения кровотока, и временные, функциональные. Нарушения кровоснабжения в матке оказывают большое влияние на тонус мышечного слоя, на рост эндометрия, на кровоток между маткой и плацентой (в беременности).
УЗИ с доплером обязательный метод обследования в период планирования беременности, в случаях патологий беременности (выкидыши, замершая беременность, бесплодие и т.д.), перед процедурой ЭКО.
В последнем случае УЗИ с доплером можно считать жизненно необходимой процедурой, так как недостаточное кровоснабжение матки влияет на размер эндометрия, а соответственно, на возможность приживления оплодотворённой яйцеклетки.
Своевременно выявленные и пролеченные проблемы в этой сфере помогут обеспечить высокую эффективность от процедуры ЭКО и избежать финансовых трат и психологических проблем от неудачного протокола.
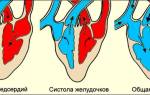
Кровоснабжение
Маточные артерии (правая и левая) являются основным поставщиком крови к матке. Небольшая часть кровоснабжения идёт от яичниковых артерий. От маточных артерий отходят аркуатные, которые дальше переходят в радиальные сосуды.
Радиальные артерии пронизывают мышечный и слизистый слои матки, разветвляясь на капиллярную сеть и питая базальный слой эндометрия (базальные сосуды и функциональный (спиральные сосуды).
Во время менструации именно спиральные артерии подвергаются функциональным (временным) изменениям. Под воздействием гормонов (прогестерона, эстрогенов) эти сосуды сжимаются, провоцируя отмирание функционального слоя эндометрия. Результатом такого явления становятся месячные.
Нормы
Кровоснабжение и ток крови в органах малого таза достаточно легко визуализируется.
Существуют определённые нормы показателей, по которым специалист может оценить состояние органов репродуктивной системы.
На все эти показатели оказывает ежедневно изменяющийся уровень половых гормонов. Поэтому такой метод обследования может косвенно указывать на необходимость обследования у эндокринолога (для определения состояния гормонального баланса).
Васкуляризация
Васкуляризация матки – что это? Васкуляризация является ещё одним параметром, определяемым при допплерометрии.
Васкуляризацией называется процесс, при котором в тканях образуются новые кровеносные сосуды (чаще капиллярная сеть). Хороший показатель это «васкуляризация в норме», больше или меньше (выше/ниже) говорит о развитии патологических процессов в органе.
Новые сосуды могут развиться по причине перекрытия основного сосуда (например, тромбом). Организм формирует новую кровеносную сеть и таким образом компенсирует недостаток кислорода и питательных веществ, поступающих к тканям. То есть васкуляризация наблюдается в местах с недостаточным сосудистым кровоснабжением.
Повышенная васкуляризация может наблюдаться при развитии новообразований в полости или толще матки, хроническом и/или остром эндометрите и других патологических состояниях. У многих пациенток с острым эндометритом единственным признаком воспалительного процесса была визуализируемая повышенная васкуляризация эндометрия.
В вопросах оценки возможного зачатия и перед процедурой ЭКО необходимо обязательно провести оценку состояния кровоснабжения репродуктивных органов. Ведь достаточно часто в основе бесплодия лежат именно нарушение кровоснабжения.
Источник: uterus2.ru
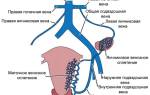
Артерии
Кровоснабжение матки осуществляется маточной и яичниковой артериями. Основным питающим сосудом является маточная артерия — a. uterina, которая отходит от внутренней подвздошной артерии и, располагаясь в основании широкой связки, направляется к матке. В области перешейка она разветвляется на две ветви — нисходящую и восходящую. Нисходящая — a. vaginalis питает шейку и стенки влагалища, образуя позади него большой анастомоз со своей контралатеральной парой. Восходящая ветвь — собственно маточная артерия располагается вдоль линии прикрепления к матке широкой связки, где и соединяется с маточной ветвью яичниковой артерии, являющейся дополнительным питающим источником.
В результате соединения двух сосудов образуется артериальная дуга, лежащая по периферии матки между листками широкой связки, откуда идут многочисленные ветви к передней и задней поверхностям, а также в толщу стенок матки.
Сам ствол маточной артерии, дуга, образуемая ею вместе с яичниковой артерией и ветви этой дуги к матке отличаются резко выраженной извилистостью. Следует отметить, что при беременности этот своеобразный характер хода артерий не исчезает — напротив, извилины увеличиваются параллельно увеличению поперечника и удлинению самой артерии.
Ветви маточной артерии проникают в матку и, следуя параллельно его внешнему контуру, образуют одну из разновидностей rete mirabile (чудесная сеть) — аккуратное сплетение, состоящее из сосудов трех типов, различающихся как расположением, так и строением. Наиболее крупные по диаметру артериальные сосуды проходят в виде дуги между наружным (продольным) и средним (круговым) мышечными слоями, образуя stratum vasculosum. От дуговой артерии в перпендикулярном ее ходу направлении идут многочисленные радиальные сосуды, гораздо меньшие по диаметру.
Во внутреннем (продольном) мышечном слое располагаются спиральные сосуды, продолжающиеся из радиальных. Они обеспечивают кровоснабжение эндометрия и представляют сеть анастомозирующих между собой капилляров с очень малым диаметром (в пределах 0,005—0,01 мм). Прежде чем радиальные магистрали входят в эндометрий, они делятся на два вида артериол. Прямые артериолы снабжают базальный слой эндометрия. Спиральные артериолы снабжают функциональный слой, и их изменения заметны на протяжении менструального цикла.
Строение стенок артерий определяется их функцией. Так, маточная артерия относится к сосудам с выраженным мышечным слоем, богатым эластическими волокнами. Во внутриматочных артериях media не имеет эластических волокон.
Вены
Кровоснабжение органа и его дренаж осуществляются артерио-венозным комплексом, сосуды которого самым непосредственным образом связаны друг с другом. Поэтому совершенно очевидна целесообразность рассмотрения закономерностей гемодинамики в совокупности с ее венозным звеном.
Венозный отток от внутренних половых органов женщины осуществляется по сосудам, которые своим ходом и названием соответствуют артериальным ветвям.
Венозные сосуды миометрия многочисленнее артериальных и образуют своеобразный каркас матки. Для вен матки характерна значительная вариабельность размеров: от микроскопических в области базального слоя эндометрия до 2 мм в диаметре в наружном слое миометрия.
Спиральные вены, обеспечивающие отток от эндометрия, продолжаются в радиальные и аркуатные вены миометрия, располагающиеся в среднем, наиболее толстом мышечном слое матки (stratum vasculosum). Ветви их сливаются с маточной ветвью маточной вены в области боковых краев органа и, анастомозируя с влагалищными ветвями, образуют маточно-влагалищное сплетение. Последнее располагается вокруг влагалища и у перешейка в слое клетчатки, находящейся между двумя листками широкой связки. Отток крови из маточно-влагалищного сплетения совершается по маточным венам, впадающим во внутренние подвздошные вены.
Особенностью венозной системы малого таза является наличие обширных сплетений из сосудов, дренирующих различные органы. Маточно-влагалищное сплетение имеет анастомозы со срамным сплетением, сплетением мочевого пузыря и сплетением прямой кишки. Кроме того, в воронкотазовой связке трубная и яичниковая ветви маточной вены образуют сплетение с маточной и трубной ветвями яичниковой вены.
К особенностям строения стенок вен относятся клапаны, представляющие собой складки внутренней оболочки полулунной формы, округленный край которых прикреплен к стенке, а прямой (или вогнутый) свободен. Вследствие этого на стенке сосуда образуется карман, обращенный отверстием в сторону тока крови. Еще одной анатомической особенностью маточных вен является наличие небольших расширений просвета непосредственно над клапанами.
Ультразвуковое исследование артериальных сосудов матки
Для изучения состояния гемодинамики внутренних половых органов женщины предпочтителен трансвагинальный доступ при комплексном использовании цветового и спектрального допплеровских режимов.
Визуализация внутренних подвздошных артерий возможна в 100% наблюдений. Расположенные ретроперитонеально, они определяются при продольном сканировании выше и латеральнее яичников в виде гипоэхогенных линейных структур, ограниченных сосудистой стенкой, которая имеет высокую эхогенность. Диаметр сосудов варьирует от 5 до 6 мм. При использовании цветового режима просвет сосуда равномерно заполняется цветом. Исследование в спектральном допплеровском режиме позволяет получить форму допплеровской кривой, характерную для сосудов с высоким периферическим сопротивлением.
Маточные артерии имеют меньший диаметр, извитой ход и более выраженную вариабельность локализации. Поэтому визуализация и идентификация их в течение ультразвукового исследования может быть затруднена. Наиболее четкое изображение маточных артерий удается получить при поперечном сканировании области внутреннего зева латеральнее маточно-влагалищного сосудистого сплетения. Визуализация маточных сосудов значительно упрощается при использовании 3D технологии.
В репродуктивном возрасте качественные (форма огибающей допплеровского спектра) и количественные (пиковая систолическая скорость кровотока, максимальная конечная диастолическая скорость, индекс периферического сопротивления, индекс пульсации) параметры кровотока изменяются соответственно фазе менструального цикла. Так, в течение овуляторного цикла отмечается статистически достоверное увеличение перфузии матки к началу второй фазы цикла. Этот процесс характеризуется увеличением пиковой систолической скорости от 40 см/с в средней стадии фолликулярной фазы до 50 см/с и выше в средней стадии лютеиновой фазы. При этом значение индекса периферического сопротивления снижается от 0,9 в середине первой фазы до 0,7 в середине второй фазы менструального цикла.
Подобная модель изменений встречается во всех ветвях маточных артерий.
В постменопаузе в связи с уменьшением перфузии органа кровоток в маточных артериях претерпевает значительные изменения. Индекс периферического сопротивления имеет высокие значения: от 0.9 до 1.0 при отсутствии циклических изменений скоростей.
При исследовании в В-режиме боковых краев матки маточные сосуды визуализируются как многочисленные эхонегативные структуры. Использование одного из цветовых допплеровских режимов позволяет легко идентифицировать их как сосуды.
Следует иметь в виду, что эхографическое изображение структуры миометрия и внутриматочных кровеносных сосудов во многом определяется контрактильной активностью матки. Маточные сокращения регистрируются при трансвагинальном исследовании во всех фазах цикла. Эти волнообразные движения перед менструацией возникают с частотой 2,3 (от 1 до 6) сокращения в минуту и направлены к внутреннему зеву. В других фазах цикла частота сокращений составляет в среднем 3,3 (от 1 до 9) в минуту в направлении дна. Самая высокая частота сократительных движений и наибольшая задействованная в этом процессе площадь миометрия регистрируются в периовуляторном периоде.
Своеобразная мелкоячеистая структура матки в В-режиме отражает наличие большого количества кровеносных сосудов в миометрии, которые четко определяются при использовании цветового режима.
При продольном исследовании матки аркуатные сосуды эхографически визуализируются как линейные структуры во внешнем слое миометрия, следующие параллельно наружному контуру органа. При динамическом наблюдении в разные фазы цикла диаметр их изменяется от 3 мм в первой фазе до 1—2 мм во второй.
Наиболее четкое их изображение может быть получено в фазе пролиферации. Однако непосредственно до и во время менструации внутриматочные сосуды визуализировать трудно. Некоторое сужение сосудов в позднюю лютеиновую фазу, а затем их дилатация в фолликулярную фазу обусловлены как циклическим действием эстрогенов, так и сократительной активностью матки.
Исследование кровеносных сосудов матки в спектральном допплеровском режиме позволяет констатировать значительные различия параметров кровотока в зависимости как от типа исследуемого сосуда (аркуатная, радиальная артерия, спиральная артериола), так и от фазы менструального цикла у женщин репродуктивного возраста. Так, скорость кровотока и индексы периферического сопротивления снижаются по мере деления сосудов на более мелкие ветви. Вместе с тем в пролиферативной фазе встречаются относительно высокие скорости и индексы периферического сопротивления по сравнению с секреторной фазой.
Ультразвуковое исследование венозных сосудов матки
Лучшая визуализация и оптимальная возможность изучения венозных сосудов малого таза обеспечиваются использованием трансвагинальной методики.
Органные вены матки изучают в средней трети миометрия (сосудистом слое) — месте локализации наиболее крупных аркуатных вен. Маточные ветви маточной вены визуализируются при сканировании боковых краев органа, венозные сосуды сплетения в воронкотазовой связке — в области трубных углов, а сосуды маточно-влагалищного сплетения — латеральнее боковых краев перешейка при сканировании на уровне внутреннего зева.
Гемодинамику в маточных венах исследуют при получении их четкого изображения дистальнее маточно-влагалищных сплетений. Внутренние подвздошные вены, расположенные ретроперитонеально, определяются в непосредственной связи с внутренними подвздошными артериями выше и латеральнее яичников при исследовании медиальной поверхности боковой стенки малого таза. В ряде случаев, в частности в постменопаузе, они благодаря постоянству локализации являются основным ориентиром при поиске постменопаузальных яичников.
В В-режиме оценивают геометрию сосуда, его диаметр, наличие пульсациии состояние сосудистой стенки. При цветовом допплеровском картировании определяют проходимость сосуда, наличие зон турбулентности и регургитации. Спектральный допплеровский режим применяют для оценки фазности допплеровской кривой и ее синхронизации с актом дыхания, расчета максимальной и усредненной по времени максимальной скоростей кровотока.
При неизмененном изображении матки у женщин как в постменопаузе, так и в репродуктивном возрасте поиск венозных сосудов миометрия может быть затруднен. Это связано с особенностью анатомического строения вен миометрия, относящихся к сосудам со слабым развитием мышечных элементов, а также с контрактильной активностью матки. У женщин репродуктивного возраста сократительные движения миометрия обусловливают кратковременную полную компрессию внутриорганных вен.
Поэтому четкая, но фрагментарная визуализация вен миометрия возможна лишь в отсутствие сократительных движений миометрия. Кроме того, изучение органного кровотока возможно при комплексном использовании цветового и спектрального допплеровских режимов, поскольку исследование сосудов только в В-режиме не позволяет получать достоверной информации о сосудистых структурах ввиду отсутствия патогномоничных критериев их визуальной идентификации.
Максимальный диаметр аркуатных венозных сосудов миометрия не превышает 2 мм. Изучение состояния стенки вен невозможно, так как ее эхогенность идентична таковой окружающего миометрия. В цветовом допплеровском режиме сосуды миометрия равномерно заполняются цветом, длина визуализируемых фрагментов может быть разной в зависимости от особенностей расположения и сократительной деятельности матки. При использовании спектрального допплеровского режима в аркуатных венах миометрия выявляется монофазный кровоток, не синхронизированный с актом дыхания. Средняя максимальная скорость кровотока во внутриматочных венах составляет 5,87 ± 3,41 см/с.
В наших наблюдениях венозное русло миометрия не удалось визуализировать у 73,6% женщин в постменопаузальном периоде длительностью более 5 лет с неизмененным изображением внутренних половых органов. Следует заметить, что у 22,3% женщин в периоде постменопаузы длительностью более 10 лет определяются линейные структуры повышенной эхогенности в месте, соответствующем в репродуктивном возрасте локализации аркуатных сосудов. Признаки кровотока в них отсутствуют. Наличие у женщин в постменопаузе гиперэхогенных линейных структур в средней трети миометрия — месте сосудистого слоя обусловлено, по-видимому, петрификацией сосудистых стенок в этом возрасте.
Маточные ветви маточных вен четко определяются в боковых краях матки в виде извитых сосудов диаметром от 3 до 5 мм с однородно эхонегативным просветом и равномерным заполнением цветом . В спектральном режиме фиксируется двухфазный кровоток, синхронизированный с дыханием и со средним значением максимальной скорости 6,2 ±2,1 см/с.
Выявление в В-режиме совокупности венозных сосудов и их извитого хода в области воронкотазовых (латеральнее трубных углов) и широких (латеральнее перешейка) связок свидетельствует всего лишь о наличии в указанных местах венозных сплетений. Для выявления варикозных деформаций требуется комплексное использование допплеровских режимов.
В сосудах венозных сплетений воронкотазовых и широких связок у здоровых женщин имеют место значительная вариабельность диаметров вен (от 1 до 5 мм, в среднем 3 мм) и извилистый ход сосудов. Просвет вен выглядит однородно эхонегативным и от окружающих тканей отграничивается тонкой эхопозитивной стенкой. Клапаны в венозных сосудах сплетений не визуализируются ввиду настолько малой толщины их створок, что их эхогенность идентична эхогенности просвета вен. В режиме цветового допплеровского кодирования просветы вен сплетений равномерно заполняются цветом.
В спектральном допплеровском режиме обнаруживается монофазный кровоток в маточно-влагалищном сплетении и двухфазный кровоток, синхронизированный с актом дыхания в сплетении воронкотазовой связки. Средняя максимальная скорость кровотока в сосудах венозных сплетений воронкотазовых и широких связок составляет 8,5 ± 3,3 и 6 ± 2,5 см/с соответственно.
Визуализация и идентификация маточных вен не представляют сложностей во всех возрастных группах и осуществляются дистальнее маточно-влагалищного сплетения. Диаметр сосудов варьирует от 4 до 7 мм, составляя в среднем 5,1 ± 0,99 мм.
Эхографические характеристики маточных вен при исследовании их в цветовом допплеровском режиме не отличаются от таковых в сосудах венозных сплетений. Однако, среднее значение максимальной скорости кровотока в маточных венах выше и составляет справа и слева 10,3 ± 3,7 и 9,9 + 3,9 см/с соответственно.
Не выявлено достоверных различий показателей венозной гемодинамики в разные фазы менструального цикла, однако в небольшой части наблюдений изменялась фазность кровотока в маточных ветвях маточных вен.
Диаметр внутренних подвздошных вен характеризуется меньшей вариабельностью от 10 до 12 мм. При использовании цветового режима просвет сосудов равномерно заполняется цветом. При использовании спектрального допплеровского режима определяется трехфазный кровоток, синхронизированный с актом дыхания. Фазность допплеровской кривой венозного кровотока отражает фазы сердечного цикла. Средняя максимальная скорость кровотока справа составляет 20,3 ± 7,2 см/с (максимальная 35 см/с, минимальная 15 см/с), слева — 18,8 ± 8,3 см/с, (соответственно 40 и 12 см/с).
Ультразвуковое исследование сосудов шейки матки
Исследование шейки матки начинают после получения ее четкого изображения в В-режиме. По сравнению с основным стволом в нисходящей ветви маточной артерии спектральный допплеровский режим демонстрирует более низкие значения пиковой систолической скорости — в среднем 12 см/с. Показатели периферического сопротивления в сосудах шейки и сосудах тела матки практически одинаковы.
Как в артериальных, так и в венозных интрамускулярных сосудах регистрируются более низкие значения скорости кровотока. Использование цветового режима позволяет четко оценить расположение экстра- и интрамускулярных сосудов, что может иметь значение в дифференциальной диагностике различных патологических состояний шейки матки.
Б.И. Зыкин, М.В. Медведев
Источник: medbe.ru